https://www.thieme-connect.com/products/ejournals/html/10.1055/s-0035-1559633
De mechanismen in de ziekte van Graves : de rol van de stimulerende, blokkerende en klievende TSH receptor antistoffen – 2015. S.A. Morshed, T.F. Davies
Onderstaande is een vertaling van de samenvatting, uitleg en conclusie van het artikel.
De immunologische processen betrokken bij de ziekte van Graves (GD) hebben één uniek kenmerk – de auto-antilichamen tegen de TSH receptor (TSHR) – die zowel een lineaire als gelijkvormige celstructuur hebben. Drie types TSHR antilichamen (stimulerende, blokkerende en klievende) met verschillende functionele capaciteiten werden beschreven bij patiënten met de ziekte van Graves, die verschillende signaaleffecten opwekken, gaande van schildkliercel-aanjaging tot schildklierceldood. Het opstellen van diermodellen van de ziekte van Graves door TSHR antilichaam overdracht of door immunisatie met TSHR antigen heeft de pathogene rol (pathogeen betekent ziekteverwekker) ervan bevestigd. Als gevolg daarvan is de ziekte van Graves het resultaat van een breuk in de TSHR tolerantie. Hier bespreken we enkele van de karakteristieken van TSHR antilichamen met speciale nadruk op nieuwe ontwikkelingen in ons begrip van wat vroeger “neutrale” antilichamen werden genoemd en die we nu karakteriseren als auto-antilichamen tegen de “splijtings”-regio van het TSHR gebied van de antistof cellen.
Achtergrond
Het TSH-receptorantigeen van de ziekte van Graves
Bij de ziekte van Graves is het belangrijkste auto-antigeen de schildklier stimulerend hormoon receptor (TSHR), die voornamelijk tot expressie komt in de schildklier, maar ook in adipocyten (cellen voor vettransport), fibroblasten, botcellen, en een verscheidenheid van andere plaatsen, waaronder het hart. Het TSHR is een G-eiwit (bedoeld voor signaal overdracht) gekoppelde receptor met 7 transmembraan-overspannende domeinen. TSH reguleert de groei van de schildklier en de productie en secretie van schildklierhormoon. Het TSHR ondergaat een complexe bewerking waarbij enkele intramoleculaire splitsingen een rol spelen; deze laatste aanpassing laat een structurele vorm van de receptor met 2 sub-eenheden achter, die uiteindelijk wordt afgebroken of waarbij het membraan van de cel wordt afgeworpen. Elk van deze gebeurtenissen kan de antigen-actie van de receptor beïnvloeden.
Humorale immuniteit tegen het TSHR
(Humoraal = met betrekking tot de lichaamsvochten) Een van de unieke kenmerken van de ziekte van Graves, niet aangetroffen bij normale personen of in de rest van het dierenrijk, is de aanwezigheid van TSHR-antilichamen (TSHR-Abs) die bij de overgrote meerderheid van de patiënten gemakkelijk aantoonbaar zijn. Bij patiënten met de ziekte van Graves overleven, net als bij andere antigenen in andere auto-immuunziekten, TSHR-reactieve B-cellen de vernietiging. Deze cellen kunnen mogelijk schildklier-autoantigenen presenteren aan T-cellen, wat ontstekingsbevordende cytokines aanmaakt. Vandaar dat zowel B-cellen als T-cellen een centrale rol spelen, niet alleen in het produceren van TSHR-antilichamen, maar ook in het mediëren van chronische ontstekingsveranderingen van de ziekte die gezien worden in de schildklier, achter de oogkas en in de huid.
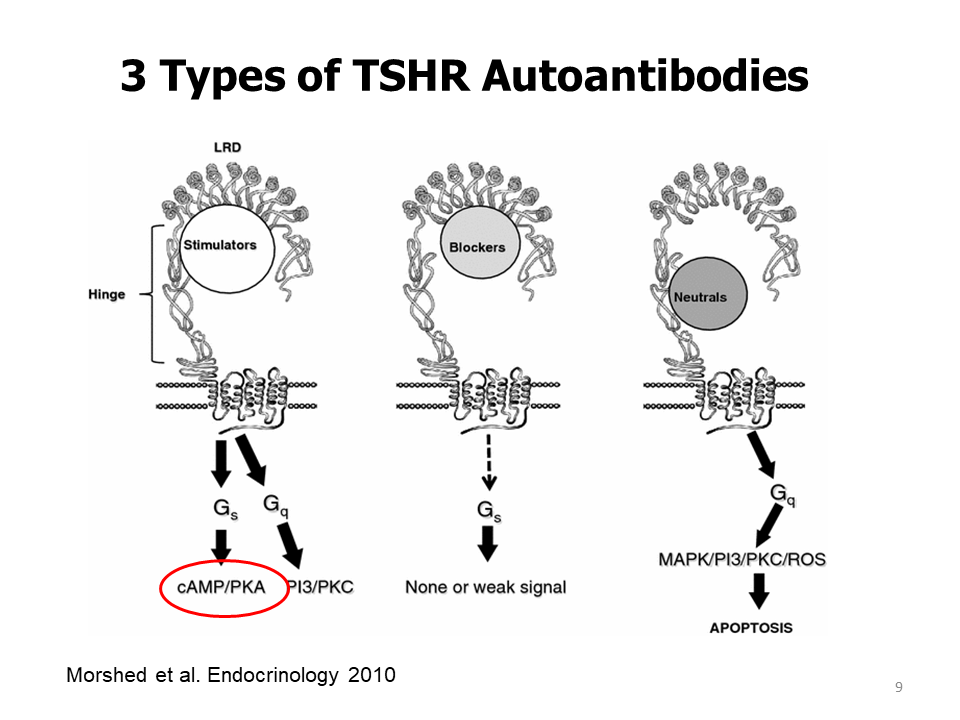
Drie soorten TSHR-Ab’s worden nu herkend bij patiënten met auto-immuun schildklierziekte. De stimulerende, blokkerende en zogenaamde “neutrale” antilichamen die karakteristiek gericht zijn tegen het klievingsgebied van de TSHR celmembranen en waarnaar in dit rapport wordt verwezen als “klievings”-antilichamen, aangezien gebleken is dat zij verre van neutraal zijn in hun biologische activiteit.
Stimulerende antilichamen binden zich alleen aan het natuurlijk gevormde TSHR en concurreren voor binding van TSH aan de receptorplaats. Deze antilichamen beïnvloeden de aanmaak van o.a de vermeerdering van schildkliercellen en de synthese en uitscheiding van schildklierhormoon.
TSHR-blokkerende antilichamen verhinderen dat TSH zich aan de receptor bindt. Wanneer zij eenmaal gebonden zijn, remmen zij de TSH-werking echter zodanig dat zij hypothyreoïdie kunnen veroorzaken, hoewel sommige TSHR-blokkerende antilichamen als zwakke TSHR-agonisten kunnen fungeren.
De klievende TSHR-antilichamen blokkeren noch de TSH-binding, noch de TSH-werking. Daarom werden ze eerst neutraal genoemd. Maar ze zijn niet neutraal, zij zijn betrokken bij cellulaire functies zoals celgroei, proliferatie, differentiatie, beweeglijkheid, overleving en intracellulair verkeer.
De aanwezigheid van verschillende proporties van TSHR-antilichamen met hoge affiniteit en gevarieerde biologische activiteit in patiënten met de ziekte van Graves draagt ongetwijfeld bij tot het klinische presentatie van de ziekte, variërend van hyperthyroïdie tot hypothyroïdie en vice versa. Daarom is een classificatie van deze antilichamen op basis van functie, zoals eerder gesuggereerd, relevanter dan hun vermogen of gebrek aan vermogen om de TSH-binding te beïnvloeden.
Apoptose in de ziekte van Graves – achtergrond
Het is nu duidelijk dat apoptose (geprogrammeerde cel vernietiging) een belangrijke rol speelt in de ontwikkeling en het voortduren van auto-immune schildklierziekte. In vroege onderzoeken werden antilichaam- en T-cel-gemedieerde celvernietingingsmechanismen voorgesteld als verantwoordelijk voor autoimmune thyrocyt vermindering in thyroiditis, maar later werden gebieden van apoptose herkend in schildklierweefsel van patiënten met de ziekte van Graves. Latere studies over apoptose hebben sindsdien nieuwe inzichten verschaft in autoimmune celvernietiging, en wijzen op de betrokkenheid van receptoren en cytokine-gereguleerde apoptotische wegen in de waarschijnlijke pathogenese en bestendiging van schildklierauto-immuniteit. Het is duidelijk dat receptoren voor dode cellen een regulerende rol lijken te spelen in apoptose, maar het is ook mogelijk dat sommige enzym-onafhankelijke mechanismen naast elkaar bestaan en bijdragen tot schildklierceldood bij de ziekte van Graves. Onze eigen waarnemingen hebben aangetoond dat TSHR-Abs verschillende effecten hebben op de apoptose van schildkliercellen.
Conclusies
Auto-immuniteit is een verzameling van ongelijksoortige aandoeningen die gecontroleerd worden door complexe genetische en omgevingsfactoren met belangrijke toevallige bijdragen. Bij de ziekte van Graves is het primaire antigeen het TSHR en de meldingen van extrathyroïde expressie van het TSHR in een verscheidenheid van celtypes waaronder fibroblasten, botcellen en immuuncellen heeft de complexiteit van de ziekte vergroot en ook een verscheidenheid van potentiële nieuwe mechanismen geïntroduceerd die hierbij betrokken kunnen zijn. Een gangbare opvatting van de ziekte van Graves is dat TSHR-Abs de ziekte bevorderen door de schildklier-antigeenexpressie te versterken. Stimulerende TSHR-Abs zijn zeker in staat om deze rol te spelen en kunnen rechtstreeks interageren met het immuunsysteem, inclusief stimulatie van rijpende immuuncellen. De activatie van T-cellen en de daaropvolgende schildklierinfiltratie bij patiënten met de ziekte van Graves zijn echter niet alleen het resultaat van rechtstreekse autoantilichaam-geïnduceerde mechanismen. De ziekte van Graves lijkt zich namelijk te ontwikkelen op een achtergrond van gelijktijdige auto-immune thyroïditis. Daarom suggereren de waarnemingen die de inductie van apoptose door klievende TSHR-Abs ondersteunen, dat dergelijke antilichamen al heel vroeg in de ziekte actief kunnen zijn en kunnen dienen om de aandoening te bestendigen wanneer deze eenmaal is vastgesteld. TSHR-Abs kunnen zelfs worden opgespoord bij een klein aantal patiënten met Hashimoto’s thyroiditis. Dergelijke TSHR-Abs zijn gerapporteerd als zijnde van de blokkerende soort, maar tot op heden zijn splitsingsantilichamen niet onderzocht bij die aandoening.
