https://bmcendocrdisord.biomedcentral.com/articles/10.1186/s12902-021-00905-4#Sec12
November 2021
Dit is een vertaling van de samenvatting van het onderzoek, waarbij meer aandacht is geschonken aan de resultaten van het onderzoek.
Achtergrond
De ziekte van Graves (GD) is een van de meest voorkomende auto-immuun schildklierziekten (AITDs) bij de mens, en thyrotropine receptor antilichaam (TSI of TSH antistoffen receptor) is een gekarakteriseerd auto-antilichaam bij GD. Het gebruik van radioactief jodium (RAJ) voor de behandeling van GD neemt toe.
Nog even een opmerking: er zijn 3 soorten antistoffen voor de ziekte van Graves, de TSI: de stimulerende antistoffen die ervoor zorgen dat de schildklier meer hormoon aanmaakt, de TBab, de blokkerende antistoffen, die voorkómen dat de schildklier hormonen aanmaakt- en de derde is een neutrale of “klievende” antistof, waarvan nog niet precies duidelijk is wat deze antistof doet.
Doelstellingen
Wij bestudeerden de biologische eigenschappen van TSI en evalueerden het effect van RAJ therapie op TSI in GD patiënten.
Methoden
In totaal werden 225 patiënten (22 beginnende GD-patiënten zonder raj-therapie, 203 GD-patiënten behandeld met 131J-therapie) en 20 gezonde personen als normale controles in deze studie opgenomen. Klinische beoordelingen werden uitgevoerd, en we onderzochten in vitro de biologische eigenschappen van TRAb in de 22 beginnende GD-patiënten en 20 controles, evenals 84 GD-patiënten met raj therapie.
Resultaten
De antistoffen TSI en schildklierperoxidase antilichaam (TPO) niveaus stegen in het eerste jaar van RAJ behandeling, en beide antilichamen daalden geleidelijk na een jaar. Na 5 jaar RAJ-behandeling daalden TSI- en TPO-spiegels bij respectievelijk 88% en 65% van de GD-patiënten. Het percentage patiënten dat positief was voor schildklierstimulerende antilichamen (TSI) was significant hoger in de groep van 7-12 maanden, en de schildklierblokkerende antilichamen (TBAb) waren na één jaar verhoogd bij de helft van de patiënten die de RAJ-behandeling kregen.
Het natuurlijk beloop van TSI en TPO bij GD-patiënten na behandeling met radioactief jodium
Om het natuurlijke beloop van TSI en TPO bij GD-patiënten na behandeling met radio-actiefjodium-therapie verder te onderzoeken, vergeleken wij de serumniveaus van TSI en TPO antistoffen voor en na Raj in de bovengenoemde vier groepen. Er kwamen geen significante verschillen in TSI- en TPO-spiegels naar voren bij vergelijking van de basislijngegevens met die na 1-6 maanden na raj behandeling (Fig. 1A, B). Na 7-12 maanden na raj-therapie stegen de serumniveaus van TSI aanzienlijk in vergelijking met de gegevens vóór de rajbehandeling (Fig. 1A). In de groep GD-patiënten na 7-12 maanden na raj-therapie werd geen significant verschil in TPO vastgesteld in vergelijking met de gegevens vóór de behandeling met raj.(Fig. 1B). Met name de serumniveaus van TPO en TSI in de GD-patiënten na 13-60 maanden of meer dan 60 maanden na raj-therapie waren significant lager dan die na 1-6 maanden na raj-therapie (Fig. 1A, B). Wij vonden ook dat de niveaus van TSI in 88% en TPO in 65% van de GD-patiënten meer dan 1,1 maal daalden na 5 jaar na hun radioactief jodium-therapie (Tabel 3; Fig. 2).
Bespreking
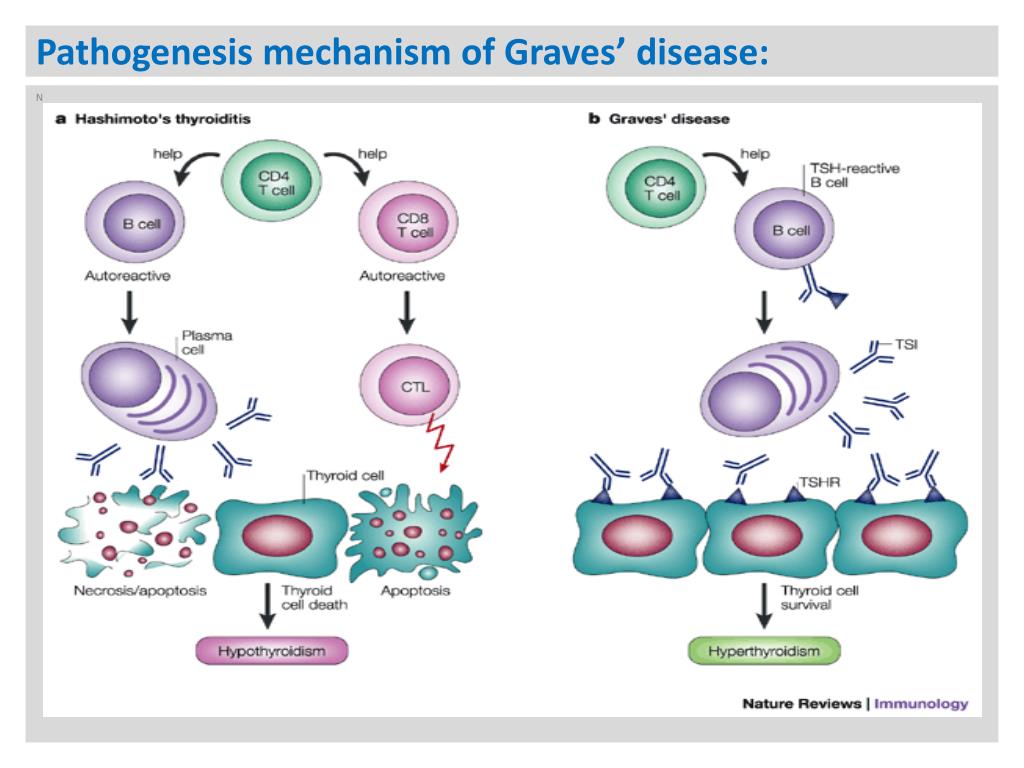
GD en HT (Hashimotos) zijn twee hoofdtypen Auto Immuun schildklierziekten met verschillende fysiopathologieën. TSI en TPO (antistoffen) zijn gekarakteriseerde autoantilichamen bij GD [22]. De TSH antistoffen receptoren vertonen drie verschillende biologische eigenschappen, waaronder TSI, TBAb en neutrale TSH-receptorantilichamen. TSI zijn verantwoordelijk voor hyperthyreoïdie bij GD, terwijl TBAb soms verantwoordelijk zijn voor een patroon van hypothyreoïdie [23]. Raj-therapie wordt steeds meer gebruikt als eerstelijns behandeling voor hyperthyreoïdie bij GD [20], en eerdere studies hebben gemeld dat patiënten met GD behandeld met een dosis radioactief jodium, hypothyreoïdie kunnen ontwikkelen. Hoewel de traditionele visie GD en HT als twee afzonderlijke ziekten beschouwt, is de huidige visie dat deze aandoeningen tegengestelde uiteinden van het spectrum van één ziekte kunnen zijn. Enkele onderzoekers hebben inderdaad een sequentiële fenotypische omzetting van GD naar HT of omgekeerd gerapporteerd [24,25,26]. Het onderliggende mechanisme is niet duidelijk, maar kan worden bepaald door de volgende factoren: TSI en TBAb activiteit, responsiviteit van de schildklier op TSI of TBAb, en veranderingen in de schildklier [23]. TSI en TBAbs zijn antilichamen tegen TSHR, maar de antigenen zijn verschillend. In de huidige studie vonden wij een periode waarin TSI en TBAbs gelijktijdig bestaan bij sommige patiënten na raj-therapie; het aandeel TSI nam af terwijl dat van TBAbs toenam. Daarom is het redelijk te veronderstellen dat raj-therapie thyrocytschade veroorzaakt bij GD patiënten, wat kan leiden tot het vrijkomen van schildklierantigenen, inclusief de holoreceptor van TSHR en andere antigenen, waardoor de auto-immuunrespons verder getriggerd wordt om de productie van TBAbs en andere auto-antilichamen tegen schildklierantigenen te induceren [28].
Een eerdere studie meldde dat HT-patiënten spontaan konden herstellen van hypothyreoïdie, waarbij TBAb verdween [31]. Daarom kan de hypothyreoïdie bij deze patiënten worden toegeschreven aan TBAb. De gegevens suggereerden dat de toename van TBAb een rol zou kunnen spelen in het proces van hypothyreoïdie bij GD-patiënten na raj-therapie.
Naast genetische en omgevingsfactoren is ook de behandeling van hyperthyreoïdie van invloed op de activiteit van GD [32, 33]. Een prospectieve gerandomiseerde studie vergeleek anti-schildklier geneesmiddelen, thyroïdectomie en radiojodium en vond dat de twee eerstgenoemde behandelingen resulteerden in een voortdurende afname van TSI, maar dat radiojodium resulteerde in een toename van TRAb na 3 maanden [34]. Lindgren et al. vergeleken TRAb, TPOAb en TGAb voor en 3 maanden na raj- therapie en vonden dat radioactief jodium een toename van deze antilichamen veroorzaakte, hoewel niet bij alle GD patiënten [35]. In de huidige studie vertoonden de meeste patiënten een toename van TSI in het eerste jaar na raj-therapie, en de meeste vertoonden een afname van TSI na 1 jaar therapie. Sommige patiënten vertoonden stijgingen in TPO antistoffen gedurende het eerste jaar na de therapie, maar het percentage was veel lager dan dat van patiënten met een verhoogde TSI. Nader onderzoek toonde een afname van TSI-positieve patiënten in de groep van 1-6 maanden en een toename van TSI-positieve patiënten in de groep van 7-12 maanden. Na één jaar namen de TSI geleidelijk af. TBAb werd echter opgewekt na raj-therapie, en het niveau steeg in de eerste 5 jaar. Na één jaar na radioactief jodium behandeling waren de meeste patiënten TBAb-positief. Na raj-therapie daalde de schildkliersecretie geleidelijk in de loop van weken tot maanden. Ongeveer 50-70% van de patiënten wordt euthyroïde binnen 6 tot 8 weken, met een gelijktijdige duidelijke vermindering van de grootte van de schildklier [36]. In het algemeen, bij ontvangst van een berekende dosis of een vaste dosis in het bereik van 10 tot 15 mCi (370-555 MBq), wordt 80-90% van de patiënten uiteindelijk euthyroïde of hypothyroïde na één dosis raj; 10-20% heeft een tweede dosis nodig, en slechts zelden een extra dosis [37]. Onze studie vond dat TSI-positiviteit vaker voorkwam bij die patiënten die 7-12 maanden na radioactief jodiumtherapie waren. Daarom suggereren wij dat de eerste behandelingsdosis radiojodium voor GD-patiënten niet hoog moet zijn en dat een iets hogere schildklierfunctie kan worden getolereerd bij patiënten in het eerste jaar na de raj-behandeling. Voor patiënten die na de eerste dosis raj een hoog T4 vertonen, kunnen anti-schildklier geneesmiddelen gunstiger zijn dan de tweede dosis raj in het eerste jaar na een radioactief jodium behandeling. Wij hebben met name een positieve relatie waargenomen tussen de raj-dosis en de ontwikkeling van hypothyreoïdie in het eerste jaar van de therapie. De incidentie van hypothyreoïdie na 1 jaar was echter ongeveer 2-3% per jaar en leek grotendeels onafhankelijk van de raj-dosis. Wij analyseerden dit verschijnsel, dat mogelijk wordt veroorzaakt door de continue aanwezigheid van TBAb, en het onderliggende mechanisme moet verder worden onderzocht. Hoewel er geen vastgesteld teratogeen risico is met radioactief jodium, is gesuggereerd de conceptie uit te stellen tot ten minste 4 maanden na de therapie [36]. In feite hebben eerdere rapporten transplacentale passage van TSI van moeder op foetus gesuggereerd als de oorzaak van neonatale schildklier disfunctie [38, 39]. Onze gegevens suggereren dat TSI-spiegels bij vrouwen in de vruchtbare leeftijd na 7-12 maanden na radio actiefjodium behandeling moeten worden opgespoord om het geschikte tijdstip voor conceptie te bepalen.
Conclusies
Wij concluderen dat behandeling met radioactief jodium een toename van TSI en TPO antistoffen in het eerste jaar na de behandeling teweegbrengt. Aangezien er na 1 jaar een afname was, moet de dosis raj niet hoog zijn, en moeten de TSI-niveaus bij vrouwen in de vruchtbare leeftijd na 7-12 maanden na radioactief jodium behandeling worden opgespoord voor besluitvorming over conceptie. In onze studie werd een tendens vastgesteld dat na raj-therapie het percentage patiënten met zowel TSI als TBAbs eerst toenam en vervolgens afnam; het percentage patiënten met TBAbs nam toe, hetgeen suggereert dat de pathogene mechanismen van de twee Auto Immuun schildklierziektes tegengestelde uiteinden van het spectrum van één ziekte kunnen zijn.
